شیوه کارکرد باتری ها طوری است که با داشتن ماده ای به نام الکترولیت (یونهای مثبت و منفی) سلولهای داخلی آن به یکدیگر وصل میشوند، سپس با اتصال باتری به یک مصرف کننده، یونهای منفی به جریان افتاده و یونهای مثبت را خنثی میکنند. با گذشت زمان یونهای مثبت بیشتری خنثی شده و به تدریج انرژی باتری کم میشود.
ستاره | سرویس محتوای کمک درسی – آیا تابحال به این سوال فکر کرده اید که شیوه کارکرد باتری ها چگونه است؟ این ابزارهای کوچک چگونه انرژی تولید میکنند؟! پیش از هر چیزی میخواهیم یک آزمایش ساده انجام دهیم و نتیجه را مشاهده کنیم. پس در مرحله اول باتری خود را به یک لامپ چراغ قوه وصل کرده و یک مدار ساده را شکل میدهیم. سپس یک گیره کاغذ را به منظور ساخت قطعهای از سیم اتصال باز کرده و آن را به قسمت پایینی باتری و گوشهای از چراغ قوه وصل میکنیم. اگر به دقت باتری را نظاره کنید، خواهید دید که لامپ چراغ قوه به دلیل حرکت الکترونها در آن، میدرخشد.

قطب مثبت و منفی
حال باید ببینیم چه اتفاقی افتاده است؟ ترمینال مثبت باتری (که در قسمت چپ شکل و به رنگ قرمز نمایش داده شده است) به الکترود مثبت، که تقریباً در قسمت داخلی باتری پنهان شده، متصل شده است. در اینجا ما به آن قطب مثبت میگوییم. قسمت بیرونی و پایین باتری نیز ترمینال منفی یا الکترود منفی را شکل میدهند. ما آن را به نام قطب منفی نیز میشناسیم و میتوانید رنگ سبز آن را در شکل مشاهده کنید. رنگ آبی در شکل نشاندهنده سیم گیره کاغذی است.
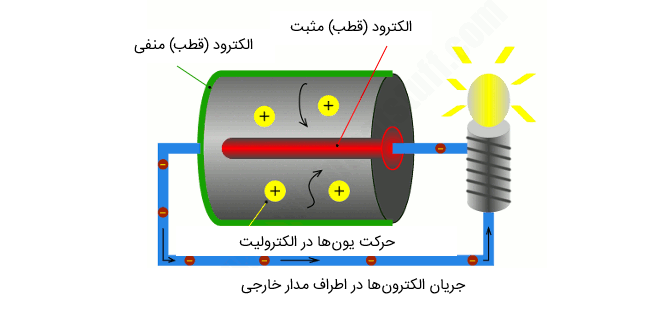
اجازه بدهید در همین ابتدا نکتهای را ممکن است موجب سردرگمی شما شود، روشن سازیم. احتمالاً در مدرسه یاد گرفته اید که کاتود به معنی الکترود منفی و انود به معنی الکترود مثبت است. اما این تقسیم بندی در واقع فقط در مواردی مانند الکترولیز (عبور الکتریسیته از میان مواد شیمیایی برای شکستن آن) کاربرد دارد.
باتریها مانند الکترولیزهایی که به طرف عقب میروند، عمل میکنند (آنها مواد شیمیایی را برای تولید الکتریسیته از هم جدا میکنند)، بنابراین اصطلاحات الکترود مثبت و منفی جایگاه خود را تغییر میدهند. از این روی، برای پیشگیری از پدید آمدن هرگونه سردرگمی، ما در ترجمه این بخش از متن از بکارگیری اصطلاحات انود و کاتود اجتناب کرده ایم. بهتر است از اصلاحات “ترمینال مثبت” و “ترمینال منفی” استفاده کنیم، به این ترتیب مقصود ما همیشه، هم هنگام صحبت درباره باتریها و هم الکترولیز یا هر موضوع دیگری، واضح خواهد بود.
واکنشهای شیمیایی
اکنون اجازه بدهید به مبحث اصلی مقاله باز گردیم. الکترودهای مثبت و منفی توسط الکترولیتهای شیمیایی از هم جدا میشوند. این الکترولیتها میتوانند مایع باشند، اما به احتمال فراوان در یک باتری معمولی به شکل پودر خشک هستند. وقتی باتری را به یک لامپ متصل کرده و آن را روشن میکنید، واکنشهای شیمیایی شروع میشوند.
یکی از واکنشها موجب میشود یونهای مثبت (که در اینجا به شکل حبابهای بزرگ زرد رنگ نمایش داده شده اند) و الکترونها (حبابهای کوچکتری که به رنگ قهوهای نمایش داده شده اند) در الکترود منفی تولید شوند. در حالی که الکترونها در اطراف محور خارجی (خط آبی) به الکترود مثبت جریان پیدا میکنند و موجب روشن شدن لامپ میشوند، یونهای مثبت به داخل الکترولیت جریان پیدا میکنند. اما در الکترود مثبت، یعنی جایی که الکترونهای وارده مجدداً با یونهای خارج شده از الکترولیت به هم میرسند، یک واکنش شیمیایی متمایز اتفاق میافتد و به این صورت مدار جریان تکمیل میگردد.
الکترونها و یونها به دلیل وقوع واکنشهای شیمیایی درون باتری جریان پیدا میکنند (که معمولاً دو عدد از آنها در یک زمان واحد جاری میشوند). واکنشهای دقیق به مواد سازنده الکترودها و الکترولیت وابسته است. هرقدر که واکنشهای شیمیایی اتفاق افتند، اصل کلی گردش الکترونها در اطراف محور خارجی و واکنش یونها به الکترولیت (ورود یا خروج از آن) در مورد تمام باتریها صدق میکند. همانطور که باتری نیرو را تولید میکند، مواد شیمیایی درون آن به تدریج به مواد شیمیایی متفاوتی تبدیل میشوند. به این ترتیب ظرفیت تولید نیروی آنها کاهش مییابد، ولتاژ باتری به تدریج پایین میآید و سرانجام باتری از کار میافتد. به عبارت دیگر، اگر باتری به دلیل خالی شدن مواد شیمیایی داخل آن قادر به تولید یونهای مثبت نباشد، نخواهد توانست الکترونهای محور خارجی را نیز تولید کند.
اکنون شاید چنین فکر کنیم که: یک لحظه صبر کنید، این سخن هیچ مفهوم خاصی ندارد! چرا الکترونها میانبر نمیزنند و مستقیماً از طریق الکترولیت الکترود منفی به الکترود مثبت وارد نمیشوند؟ در پاسخ باید گفت که الکترونها به دلیل شیمی موجود الکترولیت، نمیتوانند به این سادگی از آن عبور کنند. در واقع، تا جایی که به الکترونها مربوط است، الکترولیت یک عایق کننده محسوب میشود، یعنی یک مانع که توان عبور از آن را ندارند. در واقع آسانترین راه ورود آنها به الکترود مثبت از طریق جاری شدن از میان محور خارجی است.
قسمتهای اصلی باتری کدامند؟
واحد نیروی اصلی درون باتری به نام یاخته شناخته میشود و از سه تکه تشکیل شده است: دو الکترون (ترمینال الکتریکی) و یک ماده شیمیایی به نام الکترولیت که در میان آنها قرار دارد. اینها معمولاً برای راحتی و ایمنی ما درون یک ماده یا قالب خارجی پلاستیکی بسته بندی شده اند. همچنین دو ترمینال الکتریکی دستی وجود دارند. این ترمینالها با علامتهای مثبت و منفی نشانه گذاری شده اند و از همان قسمت خارجی به الکترودهای داخل متصل گشته اند. به زبان ساده باید گفت که تفاوت میان باتری و یاخته این است که باتری از دو یا چند یاخته متصل تشکیل شده، بنابراین نیروی آنها به یکدیگر اضافه میشود.
وقتی الکترودهای باتری را به یک مدار وصل میکنید (مثلاً وقتی آن را در یک چراغ قوه قرار میدهید)، الکترولیت فعالیت خود را شروع میکند. پس مواد شیمیایی داخل آن به تدریج به مواد دیگر تبدیل میشوند. یونها (اتمهایی که دارای تعداد بسیار اندک یا بسیار فراوانی الکترون هستند) از مواد داخل الکترودها تشکیل میشوند و در واکنشهای شیمیایی با الکترولیت مشارکت دارند. همزمان الکترونها از مدار خارجی استفاده کرده و از یک ترمینال به ترمینال دیگر عبور میکنند. به این ترتیب نیرو را به هر دستگاهی که به باتری متصل باشد، منتقل میکنند. این فرآیند تا زمان تغییر شکل کامل الکترولیت ادامه مییابد. در این هنگام یونها عبور از طریق الکترولیت را متوقف میکنند، الکترونها جریان خود از طریق مدار را قطع میکنند و طول عمر باتری به پایان رسیده است.

چرا باتریها به دو ماده متفاوت نیاز دارند؟
توجه به این نکته که الکترودهای باتری همیشه از دو ماده غیر مشابه ساخته میشوند، حائز اهمیت است. بدیهی است که این مواد باید رسانای الکتریسیته باشند. این کلید درک چگونگی و چرایی عملکرد باتریها است: یکی از این مواد مایل به ترک الکترونها و دیگری مایل به دریافت آنهاست. اگر هردو الکترود از یک ماده یکسان ساخته میشدند، این امر محقق نمیشد و هیچ جریانی پدید نمیآمد.
برای درک این موضوع لازم است به کاوش تاریخ الکتریسیته تا سال ۱۷۹۲ بپردازیم. در این تاریخ لیوگی گالوانی، دانشمند ایتالیایی کشف کرد که میتواند با کمک ران قورباغه الکتریسیته تولید کند.
روش عملکرد باتریهای خودرو
باتری خودرو، در صورت عمل، چیزی است که اغلب رانندگان آن را تصدیق میکنند. به نظر ما با استفاده از یک باتری باکیفیت میتوانید سالها اعتماد را تجربه کنید. البته این امر به مراقبت مناسب باتری و خودرو بستگی دارد. به این ترتیب، نسبت به کارایی حدأکثری سیستمهای الکتریکی و شارژی اطمینان حاصل میکنید.
در حالی که همگی ما کارکرد باتری را میدانیم و اغلب مردم درکی ابتدایی از چگونگی شارژ شدن آنها دارند، نکته کمتر دانسته شده این است که: در واقع یک باتری خودرو چگونه عمل میکند؟ پس در این بخش از مقاله به جستجوی پاسخ این پرسش میپردازیم.

اولین نکتهای که باید درک کنیم این است که برخلاف باتریهایی که در حالت معمول در وسایل الکترونیکی مانند کنترلها و ساعتها کاربرد دارند، باتری خودرو در واقع از تعداد ۶ باتری کوچکتر تشکیل شده است. این باتریها در داخل پوشش اصلی باتری به ترتیب به یکدیگر متصل شده اند. این امر موجب اضافه شدن ولتاژ هریک از باتریها شده و جملگی یک ولتاژ کلی را پدید میآورند. در مورد باتری خودرو، این ولتاژ معمولاً ۱۲ ولت است (هرچند که در واقع ولتاژ صحیح ۶/۱۲ است). مجموعه گستردهای از دیگر خودروها از همان فناوری باتری در یک دامنه ولتاژ استفاده میکنند، اما قانون و قاعده همان است.
در داخل باتری چه اتفاقی میافتد؟
۳ شیء مهم در باتری وجود دارند: ۱- دو عدد متصل کننده به نامهای الکترود منفی و مثبت، که از باتری خارج میشوند و ۲- یک محلول که قطبهای مثبت و منفی در آن مینشینند. در طول عملیات معمول، یک واکنش شیمیایی در بین محلول و انود اتفاق میافتد که الکترونهایی را که از طریق مدار جریان مییابند، آزاد میکند. این الکترونها مجدداً از طریق کاتد به باتری، یعنی جایی که واکنش شیمیایی دیگری در بین کاتد و محلول اتفاق میافتد، وارد میشوند. الکترونها در نتیجه این واکنشها ترکیب میشوند. وقتی معکوس این عمل (در تعدادی از باتری ها) اجرا میشود، الکترونها در جهت دیگری در واکنشهای معکوس تحت فشار قرار میگیرند. معمولاً به پایان رسیدن طول عمر باتری به این دلیل است که یک یا چند واکنش شیمیایی کم و بیش مورد استفاده قرار گرفته اند.
شیمی باتریها
کاتد در باتری خودرو (که معمولاً به عنوان باتری سرب اسیدی شناخته میشود) دی اکسید سرب (PbO۲)، انود یک اسفنج سرب (Pb) و محلول، اسید سولفوریک (H۲SO۴) است. وقتی باتری مورد استفاده قرار میگیرد، هر دو اتصال با نشان دادن عکس العمل به اسید سولفوریک، به منظور شکل دهی به سولفات سرب (PbSO۴) از خود واکنش نشان میدهند.
این دو واکنش عبارتند از:
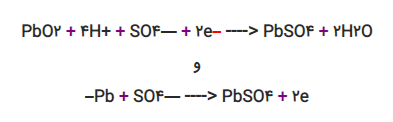
توجه داشته باشید که یکی از واکنشها الکترونها را آزاد کرده و دیگری از آنها بهره میبرد. از آنجا که الکترونها نمیتوانند به طور مستقیم از طریق محلول از مکان رها شدن خود به مکان کاربرد خود حرکت کنند، واکنش فقط در حالتی تداوم پیدا میکند که از طریق مدار الکتریکی خارجی حرکت کنند.
شارژ مجدد
واکنش معکوس زمانی اتفاق میافتد که باتری شارژ مجدد شود. میران تولید الکتریسیته این واکنش، ۲ ولت است. به این ترتیب اگر ولتاژ هر ۶ یاخته را جمع ببندیم، ۱۲ ولت لازم برای شروع به کار یک خودرو تولید شده است. این واکنش معکوس موجب میشود که بتوانیم باتریها را بارها و بارها مورد استفاده قرار دهیم.
















واقا سایتتون یه ستارس
خوب
ممنون خوب بود.
عالی.
ممنون خوب بود.
سلام
خیلی ممنون از مطالب خوب و عالی تون
بسیار جامع بود و بهتر از اون با نثر روان و قابل فهم