ایزوتوپ چیست؟ دانستن تعریف ایزوتوپ به شما کمک میکند تا با شگفتیهای بیشتری از دنیای اطرافتان آشنا شوید. چون این ذرات نادیدنی که هم خود ما از آنها ساخته شدهایم و هم دنیای اطرافمان، نقش عمدهای در زندگی ما ایفا میکنند.
ستاره | سرویس محتوای کمک درسی – همانطور که میدانید همه مواد از ذراتی به نام اتم تشکیل شدهاند. دنیای اتمها دنیای شگفتانگیزی است. همه خواص یک ماده یا عنصر بستگی به همین اتم دارد که چند پروتون یا نوترون داشته باشد. اگر برای شما هم سوال شده که ایزوتوپ چیست و مشتاق دانستن انواع آن هستید به دنیای شگفتانگیز اتمها خوش آمدید.
ایزوتوپ چیست؟
هسته اتمها تشکیلیافته از نوکلئونهایی، چون پروتون و نوترون است. به تعداد پروتونهای هر اتم عدد اتمی میگویند. عدد اتمی کلا نوع یک عنصر را مشخص میکند. مجموع پروتون و نوترون هم میشود عدد جرمی اتم. حالا اگر دو اتم عدد اتمی یکسانی داشته باشند، ولی عدد جرمیشان متفاوت باشد میشوند ایزوتوپ همدیگر. یعنی تعداد پروتونهای این دو اتم مساوی است، ولی در تعداد نوترونها با هم متفاوت هستند. پس هر دو ایزوتوپ از یک نوع عنصر هستند فقط خواص فیزیکی وابسته به جرمشان ممکن است متفاوت باشد.
دانشمندان تا به حال ۲۵۴ ایزوتوپ شناسایی کردهاند. البته این تعداد مال ایزوتوپهای پایدار است و ناپایدارها شاملش نمیشوند که در ادامه با مفهوم پایداری و ناپایداری هم آشنا میشوید.
مثالهایی از ایزوتوپ
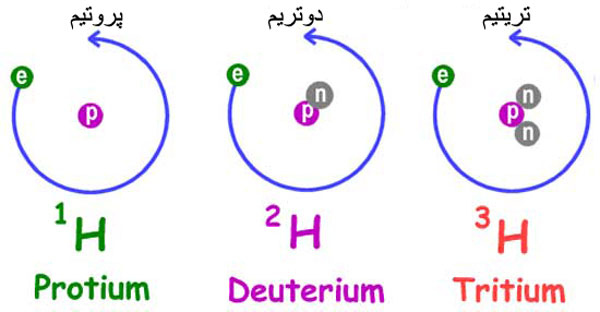
- هیدروژن سه ایزوتوپ دارد؛ پروتیم، دوتریم و تریتیم. پروتیم فقط یک پروتون دارد و نوترون ندارد. دوتریم که به آن آب سنگین هم میگویند دارای یک پروتون و یک نوترون است. تریتیم هم یک پروتون و دو نوترون دارد. البته تریتیم به طور طبیعی یافت نمیشود و باید آن را به صورت مصنوعی تولید کنند.
- منیزیم عنصری با سه ایزوتوپ میباشد. عدد اتمی هر سه ۱۲ و عدد جرمی آنها به ترتیب ۲۴، ۲۵ و ۲۶ است.
- لیتیم عنصری با دو ایزوتوپ است. عدد اتمی هر دو ۳ و عدد جرمی آنها به ترتیب ۶ و ۷ است.
- اورانیوم نیز دارای ایزوتوپهایی به نام اورانیوم ۲۳۵ و اورانیوم ۲۳۸ است.
- کلر هالوژنی با دو ایزوتوپ است. عدد اتمی هر دو ۱۷ و عدد جرمی آنها ۳۵ و ۳۷ است.
- کربن ۱۲ و کربن ۱۴ نیز هر دو ایزوتوپهای کربن هستند. یکی با ۶ نوترون و دیگری با ۸ نوترون (هر دو با ۶ پروتون).
انواع ایزوتوپ
بر اساس اینکه تعداد نوترونها چند برابر تعداد پروتونها باشد، میتوان ایزوتوپها را دسته بندی کرد:
۱- ایزوتوپهای پایدار
اگر نسبت تعداد نوترونها به تعداد پروتونها کمتر از ۱.۵ باشد آن ایزوتوپ پایدار است. ایزوتوپ پایدار به عنوان ایزوتوپی تعریف میشود که تاکنون هیچ شکلی از واپاشی آن مشاهده نشده است.
اگر نسبت نوترون به پروتون عنصر کمتر از یک و نیم باشد عنصر تمایلی به واپاشی و همینطور پرتوزایی نخواهد داشت. تا به حال ۲۵۴ ایزوتوپ پایدار شناسایی شدهاند که مربوط به ۸۲ عنصر اول جدول تناوبی (به جز تکنسیم و پرومتیم) هستند. البته پیش بینی میشود که تنها ایزوتوپهایی از ۴۰ عنصر اول (شامل ۹۰ ایزوتوپ)، نسبت به همه اشکال واپاشی پایدار باشند و سایر ایزوتوپهایی که اکنون به عنوان ایزوتوپ پایدار شناخته میشوند، حداقل در مقابل یک شکلی از واپاشی ناپایدار باشند که تاکنون مشاهده نشده است و یا ناشناخته است.

۲- ایزوتوپهای ناپایدار
اگر نسبت تعداد نوترونها به پروتونها بیشتر از ۱.۵ باشد به آن ایزوتوپ، ایزوتوپ ناپایدار میگوییم. بیشتر ایزوتوپهای ناپایدار پرتوزا هستند. همه ایزوتوپهای تکنسیوم، پرومتیوم و عناصر با عدد اتمی بیش از ۸۳ (به جز یک ایزوتوپ توریوم و دو ایزوتوپ اورانیوم) در دسته ایزوتوپهای پرتوزا جای میگیرند.
همه عناصر در طبیعت دارای بیش از یک ایزوتوپ هستند، اما آلومینیوم، فسفر، نیتروژن و سدیم فقط یک ایزوتوپ دارند در بین عناصر بیشترین تعداد ایزوتوپ مربوط به زنون با ۲۶ ایزوتوپ است که البته فقط ۸ تا از آنها پایدار هستند در صورتی که بیشترین تعداد ایزوتوپهای پایدار یک عنصر برابر با ده و مربوط به قلع است. پس از آن، چهار عنصر با هفت و هشت عنصر با شش ایزوتوپ پایدار وجود دارند. در نهایت، ۲۶ عنصر تنها یک ایزوتوپ پایدار دارند که عنصر تک نوکلید نامیده میشوند.

شباهت و تفاوت ایزوتوپها
چون خواص شیمیایی بیشتر مربوط به تعداد الکترونها میشود و بنا به تعریف ایزوتوپ، ایزوتوپها به خاطر تعداد پروتونهای برابر تعداد الکترونهای برابری هم دارند بنابراین خواص شیمیایی تقریبا یکسانی دارند. البته در سرعت واکنش دادن با هم متفاوت هستند. ایزوتوپهایی که تعداد نوترونهای بیشتری دارند با سرعت کمتری در واکنشهای شیمیایی شرکت میکنند.
ولی تفاوت در تعداد نوترونها باعث تفاوت در جرم هسته میشود و این امر ممکن است باعث شود ایزوتوپهای یک عنصر به دلیل جا به جا شدن مرکز جرم اتم در پیوندهای شیمیایی رفتارهای متفاوتی از خودشان نشان بدهند. اگرچه برای عناصر سنگینتر، میشود از تأثیر اختلاف ایزوتوپها چشمپوشی کرد.
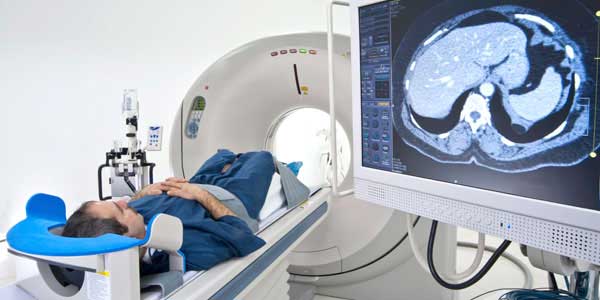
کاربرد ایزوتوپها
اینکه برخی ایزوتوپها رادیواکتیو هستند باعث شده بتوان از خاصیت پرتوزایی آنها در صنعت پزشکی استفاده کرد. از این خاصیت میتوان برای دنبال کردن مسیر مواد متحرکی که از دید پنهان هستند، مانند جریان خون در بدن یک بیمار در بیمارستان استفاده کرد. به این صورت که مقدار کمی از یک ایزوتوپ رادیواکتیو به درون جریان خون بیمار تزریق میشود. سپس مسیر آن توسط آشکارسازهای خاصی که فعالیت رادیواکتیویته را مشخص میکنند دنبال میشود. این اطلاعات به یک کامپیوتر داده میشود که صفحه آن هر اختلالی مانند انعقاد خون در رگها را نشان میدهد.
با استفاده از همین روش میشود از ایزوتوپها برای مطالعه جریان مایعات در تاسیسات شیمیایی هم استفاده کرد. آهنگ فرسودگی ماشین آلات صنعتی را هم میشود با کمک ایزوتوپها اندازه گرفت. برای این کار مقادیر اندکی از ایزوتوپهای رادیواکتیو به بخشهای فلزی ماشینآلات (مانند یاتاقان و رینگ و پیستونها) اضافه میشود. سپس سرعت فرسودگی با اندازه گرفتن رادیواکتیویته روغنی که برای روغنکاری این بخشها به کار رفته است محاسبه میشود.
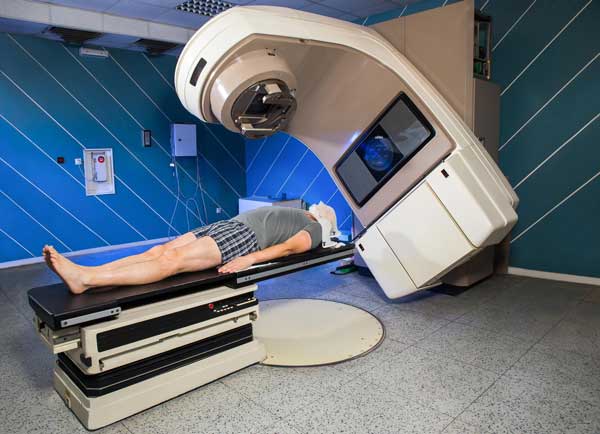
ایزوتوپها کاربردهای بسیار وسیعی هم در درمان بیماریها یا ساخت ابزار پزشکی دارند. مثلا فسفر با عدد جرمی ۳۲ برای درمان نوعی بیماری خونی (Polycythema) استفاده میشود. این عنصر پس از تغذیه توسط بیمار، در مغز استخوان جمع میشود و تولید سلولهای قرمز خون را کند میکند. به این ترتیب میتواند در درمان برخی بیماریهای خونی موثر باشد.
پلوتونیوم با عدد جرمی ۲۳۸ در ساخت تنظیمکننده قلب (گامساز Pacemaker) کاربرد دارد. در یک قلب سالم انقباض قلب با یک پالس الکتروشیمیایی شروع میشود. انقباض از گره سینوس (Sinus Node) نزدیک به قسمت فوقانی قلب شروع شده و به طرف پایین گسترش مییابد. در بعضی اشخاص به دلایل مختلف، قلب به طور همزمان با پالس گره سینوس نمیزند و به همین علت یک تنظیمکننده قلب یا گامساز که در زیر پوست جاسازی میشود، قلب را تحریک میکند.
عنصر طلا هم با عدد جرمی ۱۹۸ به خاطر اینکه از خودش اشعه گاما ساطع میکند در درمان برخی سرطانها کاربرد دارد.
شما با چه ایزوتوپهای دیگری آشنایی دارید؟ فراموش نکنید که سوالات و نظرات خود را میتوانید در بخش نظرات سایت ستاره که در انتهای همین صفحه است با ما در میان بگذارید.