ترکیبات موجود در طبیعت دارای ذرات سازندهی متفاوتی هستند. برخی از آنها از یون و برخی دیگر از مولکول تشکیل شدهاند. ترکیباتی که از یون تشکیل شدهاند، در آب رسانای جریان الکتریکی هستند. ترکیب سدیم کلرید یا نمک نوعی ترکیب رسانای الکتریسیته است. برای یافتن پاسخ پرسش چرا محلول نمک ها رسانای جریان الکتریکی است؟ که در کتاب علوم پایه نهم به آن اشاره شده، با ستاره همراه شوید.
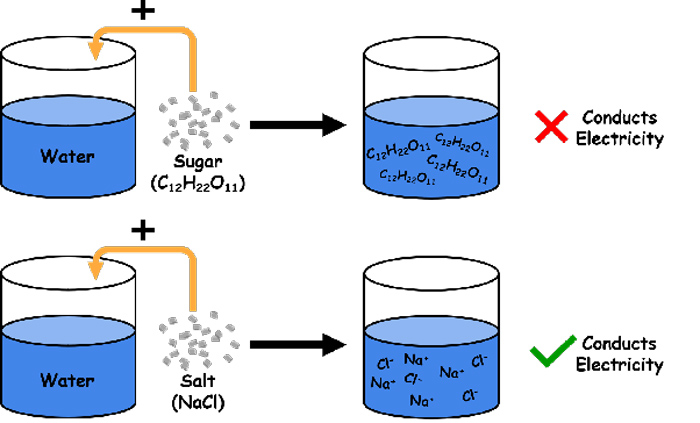
ترکیبات شیمیایی موجود در طبیعت از ذرات سازندهای به نام یون و مولکول تشکیل شدهاند. تعدادی از آنها مانند سدیم کلرید از یون و برخی از آنها مانند شکر از مولکول تشکیل شدهاند.
تفاوت ذرات سازنده در نهایت منجر به تفاوت ویژگیهایی مانند محلول یا نامحلول بودن و همچنین رسانایی و عدم رسانایی ترکیبات مختلف میشود. به عنوان مثال ترکیبی مانند سدیم کلرید یا نمک محلول در آب و رسانای جریان الکتریکی است. در مقابل شکر با وجود محلول بودن، رسانای جریان الکتریکی نیست. علت این امر تفاوت ذرات سازندهی آنها است.
در مطلب پیش رو به بررسی حرکت یون ها در آب و این پرسش میپردازیم که چرا محلول نمک ها رسانای جریان الکتریکی است؟ پرسشی که در کتاب علوم پایه نهم مطرح شدهاست. برای یافتن پاسخ این پرسش تا انتهای مطلب با ما همراه شوید.
چرا محلول نمک ها رسانای جریان الکتریکی است؟
سدیم کلرید (NaCl) از یونهای سدیم با بار مثبت (Na+) و کلرید با بار منفی (Cl-) تشکیل شدهاست. این ترکیب در آب یک محلول نمکی تشکیل داده و به یونهای سازنده خود تفکیک میشود. زمانی که ترکیبی تشکیل شده از ذرات باردار در آب حل شود، علاوه بر حرکت ذرات سازنده در سراسر آب، بار الکتریکی موجود در آن منجر به برقراری جریان الکتریکی میشود. در این مثال، زمانی که سدیم کلرید در آب حل میشود، اگر یک الکترود آزمایشگر را درون محلول قرار دهید، یونهای با بار مثبت (سدیم Na+) به سمت قطب منفی الکترود و یونهای با بار منفی (کلرید Cl-) به طرف قطب مثبت الکترود حرکت میکنند. همین موضوع باعث برقراری جریان الکتریکی در آب میشود. به همین دلیل محلول نمکها رسانای الکتریکی میشوند.
حال اگر این آزمایش را با شکر انجام دهید، ذرات سازندهی شکر در آب حل میشوند، اما جریان الکتریکی برقرار نمیشود. ذرات سازندهی شکر (C12H22O11) مولکولهای اتمی هستند. ذراتی خنثی که بدون بار الکتریکی بوده به همین دلیل به طرف قطبهای الکترود حرکت نمیکنند. بنابراین محلول شکر رسانای الکتریکی نیست.
آیا آب دیونیزه شده میتواند جریان الکتریکی را هدایت کند؟
آب دیونیزه شده یا آب یونزدایی شده آبی است که مقدار زیادی از یونهای موجود در آن حذف شدهاست. همانطور که در بحث محلول نمکی خواندیم، این ترکیب به دلیل داشتن یون در ترکیبات خود رسانای جریان الکتریکی است. اما زمانی که یون از ذرات سازندهی مادهای حذف شود، این ماده خاصیت رسانایی خود را از دست میدهد. به همین دلیل آب یونزدایی شده یا دیونیزه رسانای بسیار ضعیف الکتریسیته است و نمیتواند جریان الکتریکی را هدایت کند.
تفاوت الکترولیت و غیرالکترولیت
الکترولیت مادهای شیمیایی بوده که با حل شدن در آب به یونهای سازنده خود تجزیه میشود. به همین دلیل رسانای جریان الکتریکی است. سدیم کلرید (NaCl)، اسید استیک (CH3COOH)، سدیم هیدروکسید (NaOH)، اسید سولفوریک (H2SO4) و هیدروکلریک اسید (HCL) نمونههایی از الکترولیت هستند. به طور کلی ترکیباتی که از یون و پیوند یونی تشکیل شدهاند را الکترولیت میگویند؛ زیرا با حل شدن در آب، رسانای جریان الکتریکی میشوند.
در مقابل، غیرالکترولیت مادهای شیمیایی بوده که با حل شدن در آب خاصیت رسانایی جریان الکتریکی نخواهدداشت؛ چراکه در ذرات سازندهی خود ترکیبات یونی نداشته و از مولکول تشکیل شدهاست. شکر (C12H22O11)، اتانول (CH3COCH3) و استون (CH3OCH3) نمونههایی از ترکیبات غیرالکترولیت هستند.
جمعبندی
ترکیباتی که ذرات سازندهی آنها از یون تشکیل شده مانند نمک به دلیل داشتن بار الکتریکی زمانی که در آب حل میشوند، رسانای جریان الکتریکی میشوند. در مقابل ترکیبی مانند شکر به دلیل داشتن مولکول اتمی در ترکیبات خود، فاقد بار الکتریکی بوده و با حل شدن در آب نمیتواند جریان الکتریکی برقرار کند.

















هنوز دیدگاهی ثبت نشده است.